Проблема острых респираторных инфекций (ОРИ) является одной из актуальных во всем мире. Научный интерес к ней и ее социальноэкономическая значимость обусловлены повсеместным распространением ОРИ, высоким уровнем заболеваемости и риском развития серьезных осложнений, активным вовлечением в эпидемический процесс детского населения, а также наибольшим экономическим ущербом в структуре всей инфекционной заболеваемости. Ежегодно в мире регистрируют до 10 млрд случаев ОРИ, в России – от 27,3 до 41,2 млн. Согласно данным официального статистического сборника, в Республике Беларусь в 2005 году было зарегистрировано 3 086 665 заболеваний острыми инфекциями верхних дыхательных путей, а в 2016 году – 3 330 525 случаев (прирост 7,9%) [10, 37]. В Швейцарии и Италии почти 50% от общего количества консультаций педиатров проводится по поводу ОРИ, в Соединенных Штатах Америки ОРИ являются одной из основных причин госпитализаций, в России – 90% обращений в поликлинику и вызовов на дом приходится на ОРИ [6]. В мировом масштабе рецидивирующие ОРИ у детей создают трудности для семей пациентов и ставят серьезные задачи перед лечащими врачами.
Острые респираторные инфекции – это острые, в большинстве случаев, самоограничивающиеся заболевания респираторного тракта, проявляющиеся катаральным воспалением верхних дыхательных путей и протекающие с лихорадкой, насморком, чиханием, кашлем, болью в горле, нарушением общего состояния разной степени выраженности.
Детей, подверженных рекуррентным (повторным) случаям ОРИ, в нашей стране принято называть «часто болеющими детьми». В.Ю. Альбицкий и А.А. Баранов в 1986 году обосновали необходимость выделения группы часто болеющих детей (ЧДБ) и предложили считать ЧДБ первого года жизни, если они болеют 4 раза в год и более, детей 1–3 лет при частоте ОРИ 6 раз в год и более, детей от 3 до 5 лет при 5 и более эпизодах ОРИ в год, старше 5 лет – при 3 случаях ОРИ в год и более [2]. Некоторыми педиатрами для включения ребенка в группу ЧБД используются специальные индексы (инфекционный индекс, индекс резистентности и др.). В практике зарубежных педиатров (Великобритания, США) принято считать, что обычно здоровые дети в возрасте от 1 до 3 лет переносят до 8 эпизодов ОРИ в год. При более высокой частоте говорят о рекуррентных респираторных инфекциях [38]. Согласно определению Всемирной организации здравоохранения (ВОЗ), к ЧБД следует относить детей, переносящих более 8 эпизодов ОРИ за год [19].
Часто болеющие дети, или пациенты с рекуррентными ОРИ, – это не диагноз, а группа диспансерного наблюдения, включающая детей с частыми респираторными инфекциями, возникающими из-за транзиторных корригируемых отклонений в защитных системах организма при отсутствии стойких органических нарушений. Повышенная восприимчивость к респираторным инфекциям у ЧБД не связана со стойкими врожденными и наследственными патологическими состояниями [9].
Термин ЧБД не используется зарубежными школами и отсутствует в Международной классификации болезней, травм и причин смерти Х пересмотра, так как не является нозологической формой заболевания. Вместе с тем, за рубежом, в программах ВОЗ широко дискутируются методы лечения и профилактики рекуррентных респираторных заболеваний у детей и в этих случаях употребляется термин «recurrence infections» – «повторные, рецидивирующие инфекции».
Термин ЧБД достаточно широко известен среди ученых и практиков. Однако, несмотря на масштабные исследования по этой проблеме, проведенные ведущими педиатрами, до настоящего времени существует ряд разногласий в вопросах терминологии, этиопатогенеза, лечения, профилактики и диспансерного наблюдения данной категории пациентов.
На группу часто и длительно болеющих детей приходится 50–60% всех регистрируемых заболеваний. Около 20% детей этой группы болеют практически ежемесячно; в 40% случаев к 7–8 годам у детей формируется хроническая патология [18, 20].
Рекуррентные респираторные инфекции, особенно в раннем детском возрасте – до начала активной социализации, требуют исключения разнообразной наследственной, врожденной или приобретенной патологии (муковисцидоза, пороков развития бронхолегочной, сердечно-сосудистой систем, ЛОР-органов, гастроэзофагеальной рефлюксной болезни, первичных иммунодефицитов).
Этиология. В структуре всей заболеваемости детей доля инфекционных болезней превышает 90%. Инфекционный фактор имеет значение в 35% случаев летальных исходов [7]. На долю вирусных инфекций приходится более 97% всех случаев инфекционных заболеваний, бактериальных – 2%, прочие составляют около 1% [3]. Данное обстоятельство довольно часто приводит к необоснованному назначению антибактериальных препаратов, что создает проблему нарастающей резистентности возбудителей ряда инфекционных болезней. Видоизменяется микробный биоценоз ребенка, что ведет к изменению популяционного иммунитета у населения [4].
ОРИ вызываются огромным числом возбудителей, с учетом отдельных серотипов их насчитывается около 300 видов. Основными возбудителями являются респираторные вирусы, на долю которых приходится до 90% всех заболеваний у детей. Порядка 25–40% всех ОРВИ обусловлено риновирусами, которые относятся к группе пикорнавирусов, содержащих РНК. В настоящее время различают свыше 100 серотипов риновирусов. При риновирусной инфекции первичной областью поражения являются слизистые оболочки назофарингеальной области. Размножение вируса индуцирует продукцию медиаторов воспаления, способствующих запуску первой фазы воспаления: кининов (брадикинина, простагландинов), гистамина, интерлейкинов 1 и 8 [1].
Среди всех респираторных вирусов по масштабности (в период эпидемических вспышек) и агрессивности лидирует вирус гриппа, вызывающий одну из самых опасных инфекционных болезней по тяжести течения и последствиям перенесенного заболевания. Вирусы гриппа относятся к семейству Orthomyxoviridae, характеризующемуся одноцепочечным сегментированным геномом РНК, и подразделяются на типы А, В и С в зависимости от основных белков, входящих в их состав.
Аденовирус принадлежит к ДНК содержащим вирусам рода Mastadenovirus семейства Adenoviridae. В настоящее время известно около 100 серологических вариантов вирусов, более 40 из которых выделено у людей. В организме человека вирусы размножаются в эпителиальных клетках слизистой оболочки дыхательных путей и кишечника, конъюнктивы глаз, лимфоидной ткани. При циркуляции в крови они поражают эндотелий сосудов.
Возбудители парагриппа – пневмотропные РНК-содержащие вирусы типов 1–4 – относятся к семейству Paramyxoviridae. Они менее агрессивны, чем вирусы гриппа. Парагрипп 1-го и 2-го типа протекает как легкая форма гриппа, часто сопровождается ларингитом и отеком гортани. При 3-м типе поражаются нижние дыхательные пути, при 4-м – диагностируется выраженная интоксикация.
Респираторно-синтициальный вирус относится к РНК-содержащим вирусам семейства парамиксовирусов и обладает способностью формировать в культуре гигантские клетки и синтиций. Вирус отличается высокой контагиозностью, восприимчивость детей первого года жизни составляет 100%.
В течение последнего десятилетия в мире было выявлено более 30 новых вирусных агентов: человеческий мета- пневмовирус, коронавирус, бокавирус человека и др. [14].
Этиологическими факторами развития бактериального инфекционно-воспалительного процесса в респираторном тракте могут быть следующие патогены: пневмококки, гемолитические стрептококки группы А, гемофильная палочка, микоплазма пневмонии, хламидофила пневмонии, моракселла катаралис и др. Стафилококки и грамотрицательные бактерии (кишечная палочка, клебсиелла, протей и др.) при заболеваниях дыхательных путей, развившихся в домашних условиях, встречаются довольно редко (2–5%).
Выявлено отличие характера бактериальной флоры, вызывающей заболевания органов дыхания, у детей с рекуррентными респираторными инфекциями и эпизодически болеющих их сверстников. У всех обследованных пациентов из исследуемого материала выделялся преимущественно Streptococcus pneumoniae (45–64%), однако у детей с рекуррентными респираторными инфекциями в 70% случаев определялись его ассоциации с 2–3 бактериями, в том числе грамотрицательными (Staphylococcus aureus, Haemophilus influenzae, Klebsiella pneumoniae, Pseudomonas aeruginosa, Escherichia сoli). При сочетании микроорганизмов наблюдается высокая устойчивость к антибиотикам, что связано с их ятрогенной селекцией ввиду более частой необходимости в антибактериальной терапии различных осложнений острых респираторных инфекций у иммунокомпрометированных пациентов [27].
Общность путей и факторов передачи ОРИ повышает риск распространения и одновременного заражения несколькими возбудителями. Первичная тропность респираторных инфекций к клеткам дыхательной системы предопределяет поражение ее слизистой оболочки и проявления заболеваний. Вследствие видового разнообразия возбудителей, их биологических свойств, взаимоотношения друг с другом и с организмом хозяина возможно как типичное течение инфекционного процесса, так и развитие атипичной клинической картины. Предполагается, что в патогенезе сочетанных респираторных инфекций создается ситуация включения двух форм иммунного ответа, однако механизм взаимоотношений возбудителей изучен недостаточно. Особенностью современного течения инфекционных заболеваний у детей является частое сочетание этиологических факторов: вирус Эпштейна – Барр (ВЭБ), цитомегаловирус (ЦМВ), вирус простого герпеса (ВПГ), бактерий, грибов и паразитарных патогенов (рисунок) [1].
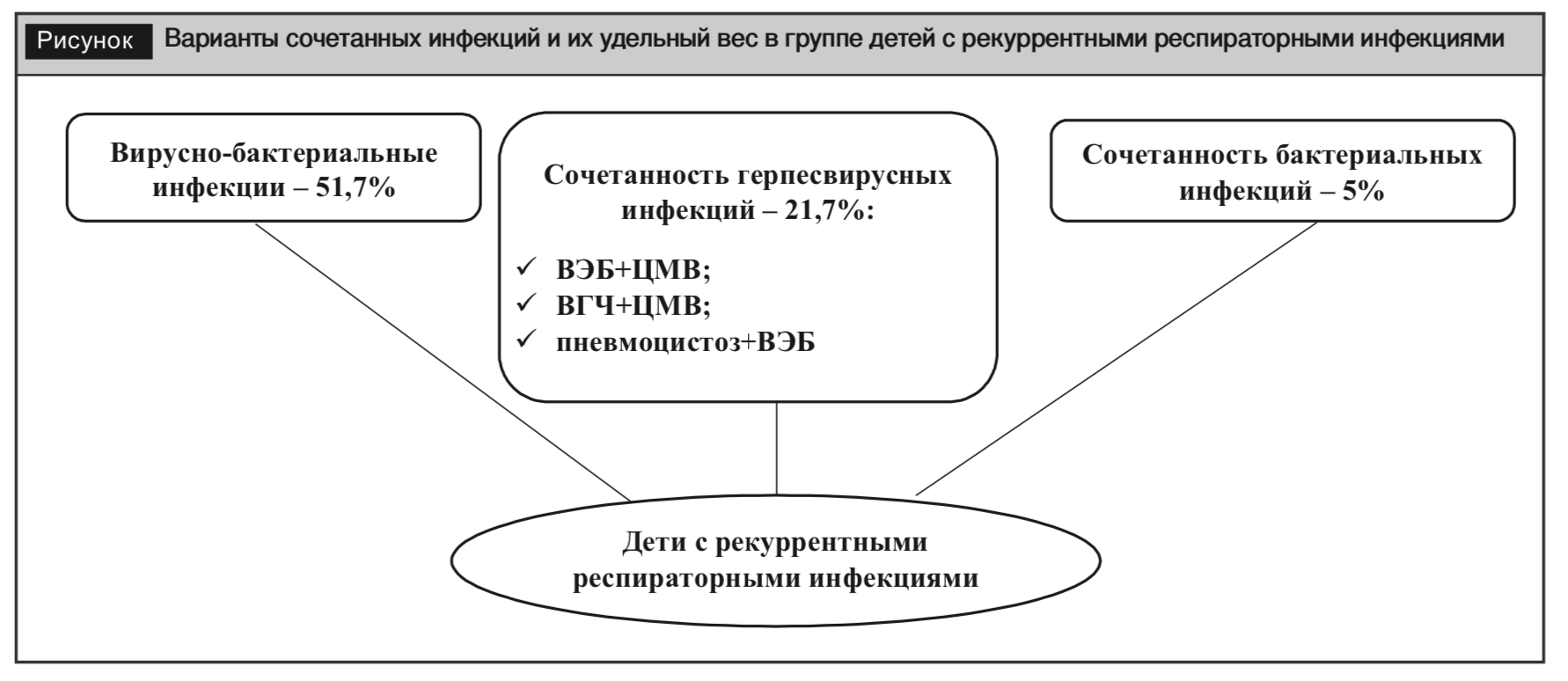
Возникновению частых респираторных инфекций способствует повышенное число контактов с источниками инфекции, а также ряд экзогенных и эндогенных факторов. К экзогенным факторам относятся: ü низкий уровень санитарной культуры в семье; ü низкий уровень материального благополучия и неблагоприятные социально-бытовые условия; · раннее начало посещения детских дошкольных учреждений; ü экологические нарушения, загрязнение атмосферного воздуха; ü нерациональное использование антибиотиков, жаропонижающих средств и др.
К эндогенным факторам относятся:
· неблагоприятные антенатальные факторы (недоношенность, морфофункциональная незрелость, перинатальная гипоксия и др.);
· анатомо-физиологические особенности дыхательной системы (мукоцилиарный клиренс, сурфактантная система, особенности строения бронхов);
· фоновые заболевания (рахит, железодефицитная анемия, лимфатикогипопластический диатез и др.);
· раннее искусственное вскармливание;
· недостаточное питание, дефицит витаминов (A, D, E, C и др.), микронутриентов (железо, йод, селен, цинк и др.), полиненасыщенных жирных кислот;
· синдром мальабсорбции;
· дисбиоз кишечника;
· хронические заболевания носоглотки;
· аллергические заболевания.
Особую тревогу вызывает рост аллергических заболеваний, распространенность которых в России варьирует от 15 до 35% (чаще у детей раннего возраста) [27]. Некоторые вирусы (грипп, парагрипп, респираторно-синтициальный вирус, риновирус) обладают способностью индуцировать синтез IgE и образование специфических IgE -антител. Поэтому при контакте с вирусной инфекцией у детей, склонных к аллергическим реакциям, могут усилиться проявления аллергии, а у детей, имеющих аллергические заболевания (бронхиальная астма, атопический дерматит, аллергический ринит, аллергический конъюнктивит), возникнуть их обострение.
Одной из частых причин развития рекуррентных респираторных инфекций у детей является физиологическая незрелость иммунной системы.
Детский иммунитет характеризуется наличием 5 основных критических периодов
Первый критический период приходится на период новорожденности (от 0 до 28 дней) и характеризуется подавлением иммунной системы ребенка. Собственная иммунная система ребенка находится в состоянии супрессии, а пассивный его иммунитет обеспечивается материнскими антителами; система фагоцитоза не развита. Новорожденный проявляет слабую резистентность к условно-патогенной, грамотрицательной флоре, поэтому у него отмечается склонность к генерализации микробно-воспалительных процессов, высокая чувствительность к вирусным инфекциям.
Второй критический период длится до 4–6 месяцев и обусловлен разрушением материнских антител. Первичный иммунный ответ на проникновение инфекции развивается за счет синтеза IgМ и не оставляет иммунологической памяти. Такой тип иммунного ответа наступает также при вакцинации против инфекционных заболеваний, и только ревакцинация формирует вторичный иммунный ответ с продукцией антител класса IgG. Недостаточность системы местного иммунитета проявляется повторными острыми респираторными вирусными инфекциями, дисбиозом кишечника, кожными заболеваниями. Дети отличаются высокой чувствительностью к респираторно-синцитиальному вирусу, ротавирусу, вирусам парагриппа, аденовирусам. Атипично, не оставляя иммунитета, протекают коклюш, корь. Дебютируют многие наследственные болезни, включая первичные иммунодефициты. Резко увеличивается частота пищевой аллергии.
Третий критический период продолжается до двух лет, когда значительно расширяются контакты ребенка с внешним миром. Сохраняется первичный иммунный ответ на многие антигены, начинается переключение иммунных реакций на образование антител класса IgG. Система местного иммунитета остается незрелой, поэтому дети остаются особенно чувствительными к вирусным и микробным инфекциям. В этот период впервые проявляются многие первичные иммунодефициты, аутоиммунные и иммунокомплексные болезни, дети склонны к повторным вирусным и микробно-воспалительным заболеваниям органов дыхания, ЛОРорганов. Проявления пищевой аллергии постепенно ослабевают.
Четвертый критический период длится с 3 до 4–6 лет. Характерной особенностью является то, что средняя концентрация IgG и IgM в крови соответствует уровню взрослых, а уровень IgA еще не достигает своих окончательных значений. Содержание IgE в плазме крови наиболее велико по сравнению с другими возрастными периодами, что, очевидно, связано с высокой распространенностью паразитарных инфекций – лямблиоза, гельминтозов. Высокий уровень IgE и низкий уровень IgА – фактор риска формирования многих хронических заболеваний полигенной природы, в том числе аллергических.
Пятый критический период заканчивается к 12–15 годам и происходит на фоне активной гормональной перестройки. При повышении секреции половых стероидов уменьшается объем лимфоидных органов. Секреция половых гормонов ведет к подавлению клеточного звена иммунитета, снижается содержание IgE. Усиливается воздействие экзогенных факторов (курение, ксенобиотики и др.) на иммунную систему. Повышается чувствительность к микобактериям. После некоторого спада отмечается подъем частоты хронической воспалительной, аутоиммунной и лимфопролиферативной патологии. Тяжесть аллергических заболеваний (бронхиальная астма, атопический дерматит и др.) у многих детей временно ослабевает.
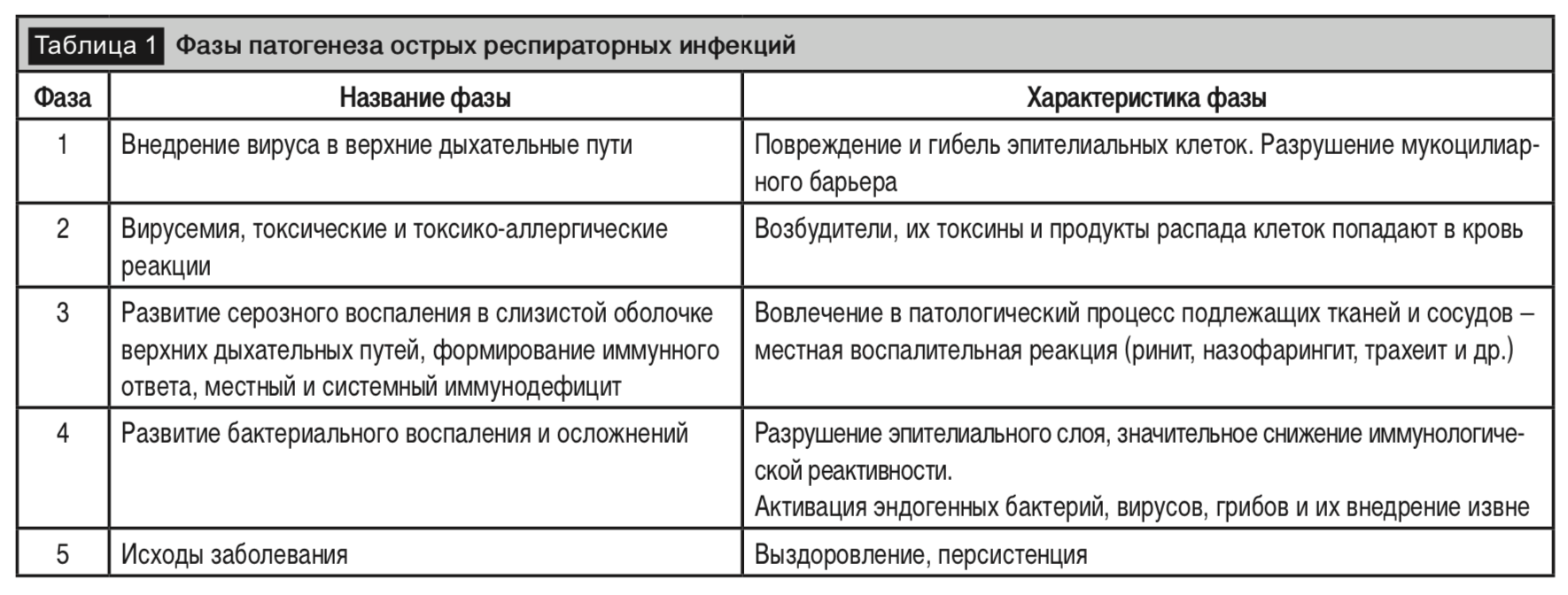
Патогенез ОРИ состоит из комплекса процессов, развивающихся на всех этапах репродукции возбудителей и их распространения в организме, а также процессов, развивающихся при взаимоотношении возбудителей с защитными системами хозяина, то есть с компонентами врожденного и приобретенного иммунитета. На внедрение возбудителя организм отвечает сложной системой защитно-приспособительных реакций, направленных на ограничение его репродукции и последующую элиминацию, а в конечном итоге, на полное восстановление возникающих структурно-функциональных нарушений (табл. 1) [30].
Таким образом, воздействие многочисленных факторов приводит к сенсибилизации детского организма, снижая его резистентность к вирусным и бактериальным инфекциям. Многократные атаки вирусов и бактерий приводят к напряжению, затем к истощению иммунной системы, к нарушениям компенсаторно-адаптационных механизмов и снижению иммунорезистентности, что и способствует хронизации процесса. Развивающаяся при этом иммунологическая недостаточность является патологическим фоном, который приводит к формированию контингента детей с рекуррентными респираторными инфекциями.
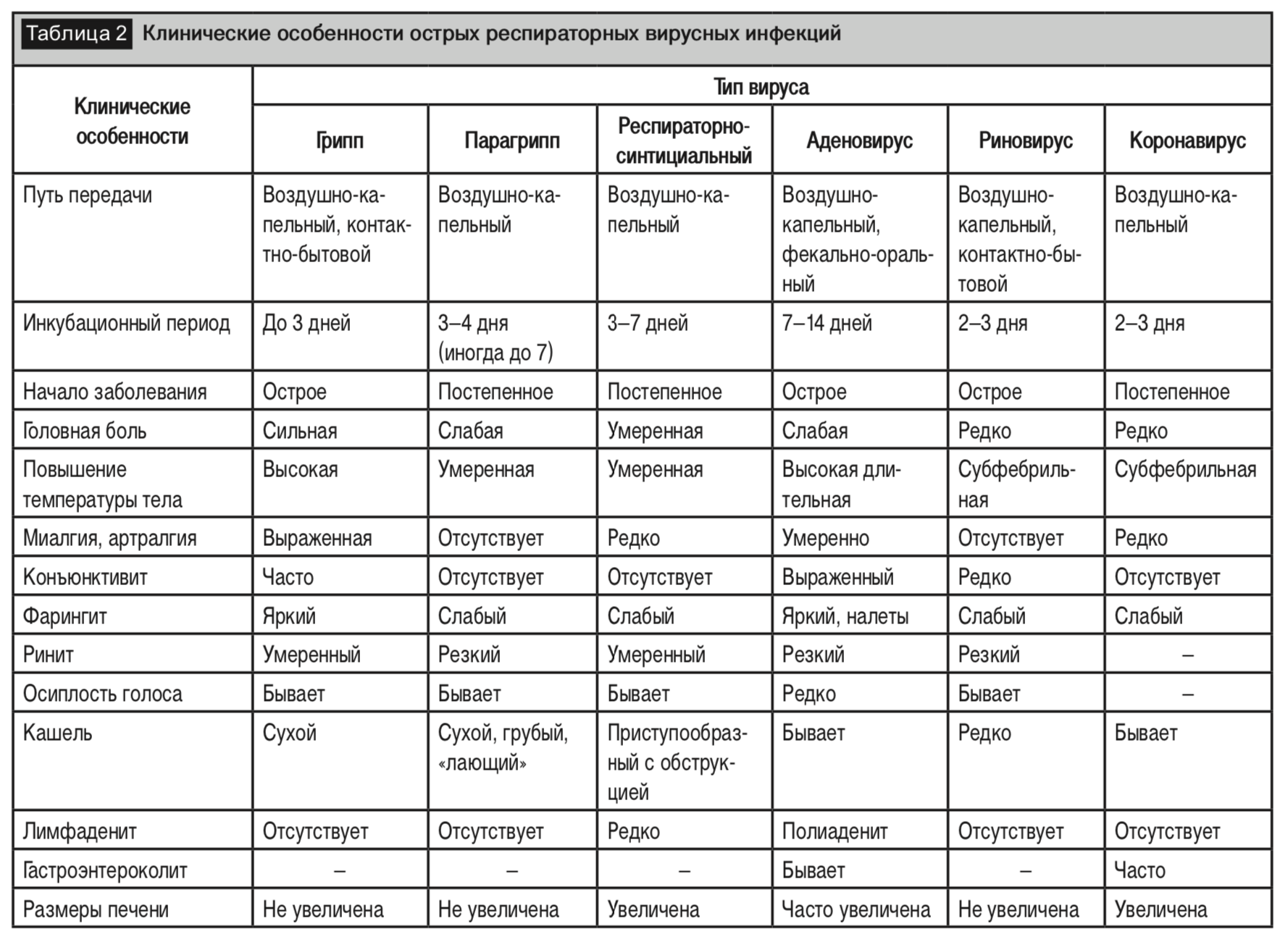
Клиническая картина ОРИ сопровождается интоксикационным синдромом (головная боль, слабость, снижение аппетита, диспепсия, миалгия, артралгия) и гипертермией. Клинические особенности острых респираторных вирусных инфекций, вызванные разными возбудителями, представлены в таблице 2 [36]. Однако типирование возбудителя в амбулаторной практике по клиническим проявлениям не всегда представляется возможным. В то же время экспрессных методов постановки диагноза для ряда возбудителей не разработано или они достаточно дорогостоящие.
Одной из наиболее тяжело протекающей ОРИ в педиатрической практике является грипп. К ведущим клиникодифференциальным признакам этого заболевания относятся выраженный токсикоз, дисциркуляторные расстройства, умеренные катаральные явления с преимущественным поражением трахеи и крупных бронхов, характерный внешний вид больных (гиперемия и одутловатость лица, выраженная инъекция сосудов склер и конъюнктив), повышенная потливость, поражение мелких сосудов, цианоз губ и слизистых оболочек, геморрагические проявления, «отсрочка» катаральных симптомов на несколько часов или на 1–2 дня, сухость слизистой оболочки носа и глотки [34]. При гриппе, как и при всех других ОРВИ, могут встречаться разнообразные осложнения в виде бронхитов, синуситов, пневмоний. Из осложнений гриппа наиболее тяжелым является инфекционно-токсический шок, клинически проявляющийся острой сердечно-сосудистой недостаточностью, отеком легких, отеком мозга, диссеминированным внутрисосудистым свертыванием.
Диагностика. В связи с особенностями строения и жизнедеятельности респираторных вирусов на ранних этапах заболевания практически все виды ОРВИ имеют схожие неспецифические изменения в общем анализе крови: лейкопения, нейтропения, лимфоцитоз, нормальная СОЭ. Для подтверждения клинического диагноза, дифференциации респираторного вируса и для эпидемиологических целей проводятся различные лабораторные методы специфической диагностики ОРВИ.
Наиболее быстрыми методами получения результатов (3–5 часов) являются иммунофлюоресцентный метод (РИФ), иммуноферментный анализ (ИФА) с выявлением антигенов вирусов в периферической крови, эпителии ротоглотки и определение антител к вирусам в периферической крови. Наиболее современный, высокочувствительный и специфичный метод, основанный на обнаружении ДНК/РНК вируса в крови, слюне, мокроте и других секретах, – полимеразная цепная реакция (ПЦР) [21].
В практическом здравоохранении пользуются реакцией торможения гемагглютинации (РТГА), реакцией связывания комплимента (РСК), реакцией непрямой гемагглютинации (РНГА), реакцией определения антител к нейраминидазе. К наиболее точным методам диагностики относится также вирусологический метод, который редко применяется на практике в настоящее время в силу жестких условий забора материала и его транспортировки [21].
Для методов ретроспективной диагностики чаще используют серологические реакции в парных сыворотках, полученных в начале заболевания и в период реконвалесценции (с интервалом 8–12 дней), при этом диагностическим является нарастание титра антител в 4 и более раз [36].
Лечение. Респираторные инфекции без своевременного и адекватного лечения часто принимают осложненное течение. ОРИ могут вызвать обострение хронических заболеваний (бронхиальная астма, атопический дерматит, пиелонефрит и др.).
Лечение ОРИ должно быть комплексным и строиться индивидуально в каждом конкретном случае. Ввиду вирусной и вирусно-бактериальной природы ОРИ, основу этиотропной терапии должны составлять противовирусные и антибактериальные препараты. Назначение этих групп лекарственных средств требует строго дифференцированного подхода [15, 22].
Пациентам сОРИ необходим строгий постельный режим. Во время заболевания на борьбу с инфекцией тратится большое количество энергии, поэтому дополнительный расход энергии на подвижные игры отрицательно сказывается на течении болезни.
Обильное теплое питье крайне необходимо детскому организму для борьбы с инфекцией и ликвидации интоксикации. В качестве питья можно рекомендовать ребенку черный чай, отвары из ягод клюквы, плодов шиповника, компоты из свежих и сушеных фруктов и ягод, щелочную минеральную воду без газа. Травяные чаи, чай с малиновым вареньем, медом можно рекомендовать с осторожностью детям старшего возраста при отсутствии атопических заболеваний и отягощенной наследственности по аллергическим заболеваниям.
Жаропонижающие препараты. Повышение температуры тела – это естественный процесс при ОРИ, который замедляет размножение вирусов. Поэтому если ребенок хорошо переносит температуру, отсутствует головная боль, вялость, сонливость, судороги на подъем температуры тела (в анамнезе), жаропонижающие можно не применять до температуры 38,5 °С. Препаратом выбора сегодня является ибупрофен (Ибуфен), который назначается из расчета по 5–10 мг/кг 3–4 раза в сутки (но не более 20–30 мг/кг в сутки) [35, 36].
Ирригационная терапия. Цель ирригационной терапии – превентивное активное снижение количества вирусных и бактериальных патогенов на слизистых оболочках верхних дыхательных путей. Рекомендуется промывание носоглотки раствором соли физиологической концентрации (физиологический раствор, аква марис, аквалор и др.).
Интраназальные деконгестанты. Противоотечные интраназальные препараты наиболее часто назначают при насморке, когда отмечается гиперсекреция слизи и отек слизистой оболочки носа. С целью устранения этих неприятных проявлений ОРИ используются только местные деконгестанты: оксиметазолин, ксилометазолин, тетризолин, нафазолин. Они вызывают местную вазоконстрикцию слизистой оболочки, благодаря этому уменьшаются гиперемия и отек, снижается секреция слизи, восстанавливается отток слизи из параназальных синусов, их воздушность, нормализуется давление в пазухах и евстахиевой трубе, улучшается аэрация среднего уха. В педиатрической практике с целью профилактики передозировки родителями лекарственного препарата данной группы рекомендуется галазолин, продолжительность действия которого 8–12 часов.
Противокашлевая терапия. Использование истинных противокашлевых препаратов для подавления кашля у детей крайне редко и рекомендуется лишь после 12 лет. Необходимость в назначении данной группы препаратов возникает тогда, когда кашель нарушает самочувствие и состояние больного. К противокашлевым препаратам относят ненаркотические лекарственные средства центрального действия (глаувент, тусупрекс, синекод, пакселадин) и средства периферического действия (либексин).
Целью рациональной терапии кашля является разжижение мокроты, снижение ее вязкости и увеличение эффективного кашля. Для этого используют препараты, стимулирующие отхаркивание (щелочные растворы и фитопрепараты – гелисал, бронхипрет, проспан и др.), и муколитики (бромгексин, амброксол, ацетилцистеин и др.) [37].
Противовоспалительная терапия. В острой фазе вирусной инфекции воспалительный процесс развивается классическим образом: в ответ на вирусную агрессию происходят сосудистые изменения, связанные с вазодилатацией, увеличением проницаемости эндотелия, экссудацией. Все это приводит к отеку тканей, высвобождению медиаторов воспаления (гистамин, серотонин, лейкотриены LTC4 , LTD4 , LTE4 ) и изменению секреции слизистой оболочки дыхательных путей, чаще – к гиперсекреции. В итоге нарушается проходимость дыхательных путей, снижается мукоцилиарный клиренс и создаются предпосылки для развития осложнений (обструкция, отек слизистой оболочки дыхательных путей и паренхимы легких, развитие бактериального процесса). Фенспирида гидро-хлорид (сиресп, эреспал) способствует улучшению мукоцилиарного клиренса и разрешению кашля, уменьшает действие основных патогенетических факторов респираторных инфекций. Оптимально данный препарат назначать детям без атопических заболеваний и при отсутствии отягощенного аллергологического анамнеза.
В качестве эффективной противовоспалительной терапии у детей с атопическими заболеваниями и отягощенным аллергологическим анамнезом рекомендуется антагонист лейкотриеновых рецепторов – синглон. Лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа, участвующим в сокращении гладких мышц дыхательных путей, повышении сосудистой проницаемости, секреции слизи и плазматической экссудации. Синглон селективно ингибирует CysLT1 рецепторы цистеиниловых лейкотриенов (LTC4 , LTD4 , LTE4 ) эпителия дыхательных путей, а также предотвращает у больных с отягощенным аллергологическим анамнезом бронхоспазм, обусловленный вдыханием цистеинилового лейкотриена LTD4 . Кроме того, препарат вызывает бронходилатацию в течение 2 часов после приема внутрь и может дополнять бронходилатацию, вызванную β2 -адреномиметиками. Синглон не только оказывает противовоспалительное действие на дыхательные пути, но и обладает отчетливым системным противовоспалительным эффектом [13]. Детям с 15 лет синглон назначают по 10 мг 1 раз в сутки. Доза препарата для детей в возрасте 6–14 лет составляет 5 мг в сутки, от 6 месяцев до 4 лет – 4 мг в сутки. Максимальная концентрация препарата в крови у взрослых и подростков с 15 лет достигается в течение 3–4 часов, а у детей до 8 лет, получающих синглон в дозе 4–5 мг в сутки, – в течение 2,6 часа. Антибактериальная терапия.
Антибактериальная терапия при ОРИ малоэффективна и показана не более чем в 10% всех случаев заболевания. Необоснованное назначение препаратов этой группы повышает риск возникновения побочных явлений, нарушает микробиоценоз кишечника, снижает иммунитет, формирует лекарственную резистентность и др. Показанием к назначению системных антибиотиков является развитие бактериального воспалительного процесса: гнойный средний отит, гнойный синусит, острый бактериальный тонзиллит, паратонзиллит, эпиглотит, обструктивный ларинготрахеит со стенозом гортани 2–3-й степени, острый бактериальный трахеит и/или бронхит, пневмония [33].
На бактериальную природу респираторной инфекции указывают: длительная, более трех дней, фебрильная лихорадка; одышка без бронхообструкции; асимметрия хрипов в легких; появление гнойных налетов и гнойного/ гнойно-слизистого отделяемого; наличие лейкоцитоза и нейтрофилеза со сдвигом лейкоцитарной формулы влево; рентгенологические данные [16, 17].
«Золотым стандартом» антибактериальной терапии ОРИ бактериальной природы является назначение лактамных антибиотиков: пенициллинов и цефалоспоринов I–III поколений. Из группы пенициллинов следует отдавать предпочтение амоксициллину, доза которого составляет 40–60 мг/кг в сутки, а детям с массой тела более 40 кг – от 750 мг до 3 г в сутки.
Противовирусная терапия наиболее частых вирусных инфекций затруднена в силу узости спектра действия противовирусных препаратов (ремантадин, озельтамивир, реленза), возрастного ограничения их применения у детей (ингавирин, озельтамивир, реленза, амиксин и др.) и недостаточной доказательной базы эффективности данной группы препаратов [5, 23, 24, 28, 32].
В настоящее время активно используется в терапии ОРИ вирусной этиологии гроприносин, обладающий противовирусным и иммуностимулирующим действием. Стимулируя дифференцировку Т-лимфоцитов в цитотоксические Т-клетки и Т-хелперы, а также повышая продукцию лимфокинов, препарат способствует выработке интерлейкинов 1, 2, интерферона-g. Инозин пранобекс повышает функциональную активность NK-клеток; усиливая хемотаксис макрофагов и фагоцитоз, потенцирует морфофункциональную состоятельность нейтрофилов и моноцитов. В то же время, стимулируя дифференцировку В-лимфоцитов в плазматические клетки и повышая продукцию антител, препарат нормализует гуморальный иммунитет. Препарат проявляет противовирусную активность in vivo в отношении вирусов гриппа А и В. Механизм противовирусного действия Гроприносина связан с подавлением биосинтеза вирусной РНК и трансляции вирусных белков, что приводит к ингибированию репродукции вирусов [8, 11, 25, 31].
Сочетание неспецифического противовирусного и иммуномодулирующего действия является важным преимуществом препарата гроприносин, обусловливая его эффективность при заболеваниях вирусной и смешанной (вирусно-бактериальной) природы. Он способен, с одной стороны, активировать Т-клеточный иммунный ответ, а с другой – снижать синтез провоспалительных цитокинов клетками воспаления (макрофаги, нейтрофилы). Это уменьшает иммунопатологические последствия вирусных инфекций. В совокупности снижение вирусной нагрузки и оптимизация работы иммунной системы обеспечивают такие клинические эффекты гроприносина, как:
· быстрая локализация очага инфекции (что, в свою очередь, дополнительно снижает вирусную нагрузку);
· ускорение обратного развития воспалительных процессов; ü облегчение течения вирусных заболеваний;
· сокращение сроков реконвалесценции;
· увеличение периодов ремиссии при хронических рецидивирующих заболеваниях;
· снижение риска осложнений, вероятности реинфекции и бактериальной суперинфекции.
Применение гроприносина при лечении ОРИ у пациентов с ослабленным иммунитетом также позволяет снизить число осложнений, значит, и потребность в назначении антибиотиков и других лекарственных средств, сокращает сроки госпитализации. Инозин пранобекс относится к малотоксичным веществам и в этом отношении имеет преимущества перед другими синтетическими противовирусными препаратами и иммуномодулирующими средствами с противовирусной активностью [26, 27, 29].
Опубликованные результаты изучения эффективности применения препарата, а также данные собственных исследований позволяют рекомендовать гроприносин для лечения и профилактики ОРИ у детей [11, 12]. Гроприносин в сиропе разрешен к применению детям с одного года в дозе 50 мг/кг в сутки, разделенной на 3–4 приема. Данная форма выпуска рекомендуется детям до 6 лет. Детям более старшего возраста показан препарат в виде таблеток в той же дозировке. Лечение необходимо начинать с первых признаков болезни и продолжать до момента исчезновения клинических симптомов. При необходимости длительность лечения может быть увеличена индивидуально под контролем врача.
Профилактика ОРИ и реабилитация детей с рекуррентными респираторными инфекциями. Дети с рекуррентными респираторными инфекциями подлежат проведению профилактических мероприятий, направленных на снижение уровня респираторной заболеваемости. Основу профилактики составляет формирование собственного адекватного иммунного ответа [22, 33]. Этому способствует оптимизация образа жизни: рациональный режим дня, полноценное питание, контроль за окружающей средой. Коррекция режима дня направлена на временное ограничение занятий и игр, приводящих к переутомлению, перевозбуждению ребенка; уменьшение стрессовых ситуаций, нормализацию сна. Питание ребенка должно быть разнообразным и содержать адекватное количество витаминов и микроэлементов с учетом суточной потребности в белках, жирах и углеводах. Ежедневный рацион должен включать свежие овощи, фрукты, соки, а в период эпидемических вспышек – продукты, содержащие фитонциды – свежий лук, чеснок. Контроль за окружающей средой предусматривает, в первую очередь, исключение курения и особенно пассивного, а также уменьшение контактов с источниками инфекции в семье и детских дошкольных учреждениях и удлинение времени пребывания на свежем воздухе. Закаливание – один из важных методов профилактики ОРИ. В основе закаливания лежит тренировка вазомоторных механизмов адекватной реакции на холодовые воздействия. Систематическое контрастное воздушное или водное закаливание сопровождается повышением устойчивости организма к температурным колебаниям окружающей среды и повышением иммунологической реактивности организма.
Медицинская реабилитация включает следующий комплекс мероприятий:
· санация хронических очагов инфекции;
· ликвидация недостаточности микроэлементов: железо, йод, селен, цинк и др.;
· ликвидация недостаточности витаминов А, D, E, C и др.;
· физиотерапевтические методы (массаж, спелеотерапия и др.);
· иммуномодуляция.
Одним из современных лекарственных средств, предназначенных для профилактики ОРВИ, является гроприносин. Доказана эффективность препарата в профилактике и реабилитации часто болеющих детей, относящихся к группе риска в связи со сниженным иммунитетом. Применение гроприносина позволяет существенно снизить респираторную заболеваемость и облегчить течение клинических симптомов острых респираторных вирусных инфекций [8, 11, 12].
С целью профилактики ОРИ у детей рекомендуется назначение гроприносина из расчета 50 мг на кг массы тела в сутки в 3 приема, 3 раза в неделю в течение 2 месяцев.
Диспансеризация детей с рекуррентными респираторными инфекциями. Дети с рекуррентными респираторными заболеваниями нуждаются в диспансерном наблюдении врача-педиатра по II группе здоровья. В соответствии с этим для них разрабатываются программы профилактики. После перенесенной ОРИ ребенок освобождается от занятий физкультурой на 10 дней, затем рекомендуется подготовительная группа. Врач-педиатр осматривает ребенка 4 раза в год, оториноларинголог и стоматолог – 2 раза в год, другие специалисты – по показаниям. Показано исследование общего анализа крови и мочи 2 раза в год; биохимический анализ крови и иммунограмма – по показаниям. Снятие ребенка с диспансерного учета осуществляется при уменьшении частоты ОРИ в возрасте до 3 лет – до 4 раз, 3–5 лет – до 3 раз, 5–7 лет – до 3 раз и уменьшение продолжительности одного заболевания до 8 дней.
Таким образом, учитывая высокую социально-экономическую значимость рекуррентных респираторных инфекций и широкий спектр предрасполагающих факторов, необходима организация обучающих семинаров для врачей-педиатров для выделения групп риска и своевременного проведения профилактических и лечебных мероприятий. В качестве эффективных препаратов выбора при лечении ОРИ можно рекомендовать синглон, снижающий риск развития обструкции и обострения аллергических заболеваний, и гроприносин, обладающий направленным этиотропным и иммуномодулирующим эффектом.
