Представлены механизмы активации иммунного и цитокинового статуса при приеме инозина пранобекса здоровыми лицами и пациентами с различной патологией. В отдельных разделах представлены результаты клинических испытаний лекарственного средства при разных инфекционных и неинфекционных болезнях, сведения об его антивирусной активности по отношению к различным возбудителям, а также последние данные белорусских вирусологов, доказавших наличие у инозина пранобекса противовирусной активности к различным штаммам вируса гриппа А и В. 50-летний опыт применения инозина пранобекса доказывает его безопасность и перспективу дальнейшего применения.
Инозин пранобекс (ИП) (C52H78N10O17, 9-[(2R,3R,4S,5R)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]-6,9-dihydro-3H-purin-6-one, methisoprinol, ISO, изопринозин)представляет соединение инозина с 1-(диметиламино)-2-пропанол-4-(ацетиламино) бензоатом (соль) в соотношении один к трем и по своим основным фармакологическим характеристикам является иммуномодулирующими противовирусным лекарственным средством, лицензированным с 1971 года по всему миру, включая Республику Беларусь [1].
Дефицит данных о возможном неблагоприятном действии ИП устранен проведением кометного и микроядерного анализов, а также теста Эймса, на основании результатов которых сделано заключение об отсутствии у инозина пранобекса генотоксичного и мутагенного действия [2]. Профиль безопасности ИП установлен в ходе клинических испытаний при различных заболеваниях у разных групп населения [3].
В научной литературе последних лет немало обзоров литературы, посвященных механизмам действия ИП, где сконцентрированы основные эффекты ИП при ряде инфекционных и неинфекционных болезней, при которых применяется ИП за последние 50 лет: подострый склерозирующий панэнцефалит(ПСП), герпетические инфекции, представленные вирусом простого герпеса (ВПГ), вирусом Эпштейна-Барр (ВЭБ), цитомегаловирусом (ЦМВ), папилломавирусная инфекция, ВИЧ-инфекция, грипп и острые респираторные вирусные инфекции (ОРВИ) и другие [4].
Цель – представить основные этиологические и клинические эпитопы фармакологического действия ИП по данным литературы последних лет.
Влияние ИП на иммунную систему. Редкими и интересными результатами, позволяющими установить влияние ИП на иммунную систему, являются исследования на здоровых добровольцах. В одной из публикаций пред-
ставлены данные по изменению цитокинового статуса у 10 здоровых лиц среднего возраста (41 год), которые
принимали ИП по 1 г 3 раза в день 5 дней подряд [5]. Изменения показателей иммунитета контролировали по уровню цитокинов в течение 3 недель (до приема, на 7, 10, 14, 21, 28, 35 и 42-й день). Мониторинг показателей показал повышение уровня IFN-гамма, IL-2, IL-10 и TNF-альфа в сыворотке крови на 7–10-й день. Уровни IL-2 повторно повысились на 42-й день после снижения до начальных значений (р < 0,05; р < 0,001 соответственно). Уровень IL-10 увеличился с 7-го по 28-й день контроля (р < 0,01). Практически отсутствовала динамика со стороны TNF-альфа после незначительного увеличения на 10-й день (р > 0,05). Обнаружена умеренная отрицательная корреляция между IFN-гамма и IL-2, IL-10 и TNF-альфа (r по Спирману: –0,63, –0,62, –0,63; р < 0,05, соответственно). Тем самым авторы продемонстрировали иммуномодулирующие свойства ИП у здоровых взрослых лиц.
Среди такой же категории исследуемых, отнесенных к здоровым лицам, изучено влияние ИП на показатели клеточного иммунитета, в частности на популяции лимфоцитов: CD19+ B-клетки, CD3+ T-клетки, CD4+ T-хелперы, FoxP3hi/ CD25hi/ CD127lo регуляторные Т-клетки (Tregs), CD3/CD56+ NK-клетки и CD3+/CD56+NKT-клетки, а также уровень сывороточных иммуноглобулинов и подклассов IgG [6, 7]. Установлено раннее повышение количества NK-клеток (в процентах от общего количества лимфоцитов периферической крови), сохраняющееся в течение 2 недель у здоровых добровольцев, которым ИП вводили по 4 г ежедневно 14 дней.
Влияние ИП на продукцию цитокинов, относящихся к Th1 (IL-2, IFN-g и TNF-a) или Th2-клеткам (IL-4, IL-5 и IL-10), изучено в культуре лимфоцитов периферической крови человека, стимулированных фитогемагглютинином (PHA). Показано, что ИП значительно усиливал секрецию TNF-a (в краткосрочной – 24-часовой и длительный период – 72-часовой культуры) и IFN-g (в 72-часовой культуре). К удивлению авторов работы, производство IL-10 с помощью
PHA-стимулированных лимфоцитов ИП подавлялось дозозависимым образом как в 24-часовой, так и в 72-часовой культуре. Эти результаты демонстрируют иммуномодулирующий эффект ИП и обосновывают его применение у пациентов с угнетенной функцией иммунной системы [8].
Учитывая, что иммуномодулирующая активность ИП характеризуется повышенной пролиферацией лимфоцитов, продукцией цитокинов, цитотоксичностью NK-клеток, а также активацией передачи сигналов NKG2D на NK-клетках, CD8+ Т-клетки и γδ Т-клетки, проверена гипотеза, что ИП изменяет клеточный иммунитет посредством индукции экспрессии лиганда NKG2D на клетках-мишенях, тем самым усиливая активацию иммунных клеток через рецептор NKG2D. Установлено, что ИП вызывает увеличение внутриклеточной концентрации пуриновых нуклеотидов и промежуточных соединений трикарбоновых кислот (ТСА) и индукциюлиганда NKG2D. Степень индукции лиганда NKG2D была функционально значимой, что приводило к увеличению NKG2D-зависимой иммуногенности клеток-мишеней [9].
Влияние ИП на грипп и гриппоподобные инфекции. Большинство исследований, включая работы последних лет, посвящены клиническим аспектам изучения эффективности ИП при острых респираторных вирусных инфекциях (ОРВИ). Результаты исследования подтверждают эффективность применения ИП в сравнении с плацебо у здоровых лиц без ожирения в возрасте до 50 лет с клинически диагностированными гриппоподобными заболеваниями [10].
Эффективность и безопасность применения ИП подтверждены в рандомизированном плацебо-контролируемом двойном слепом исследовании фазы 4 у пациентов с клинически диагностированными гриппоподобными заболеваниями, вызванными вирусом гриппа A и B, респираторно-синцитиальным вирусом (РСВ), аденовирусом (АВ) и вирусами парагриппа (ПГ) 1-го и 3-го типа [11]. Всего в обследование было включено 463 пациента, которые получали ИП (n = 231) и плацебо (n = 232). ИП и плацебо в дозе 500 мг пациенты получали в течение 7 дней (по 2 таблетки внутрь 3 раза в день).
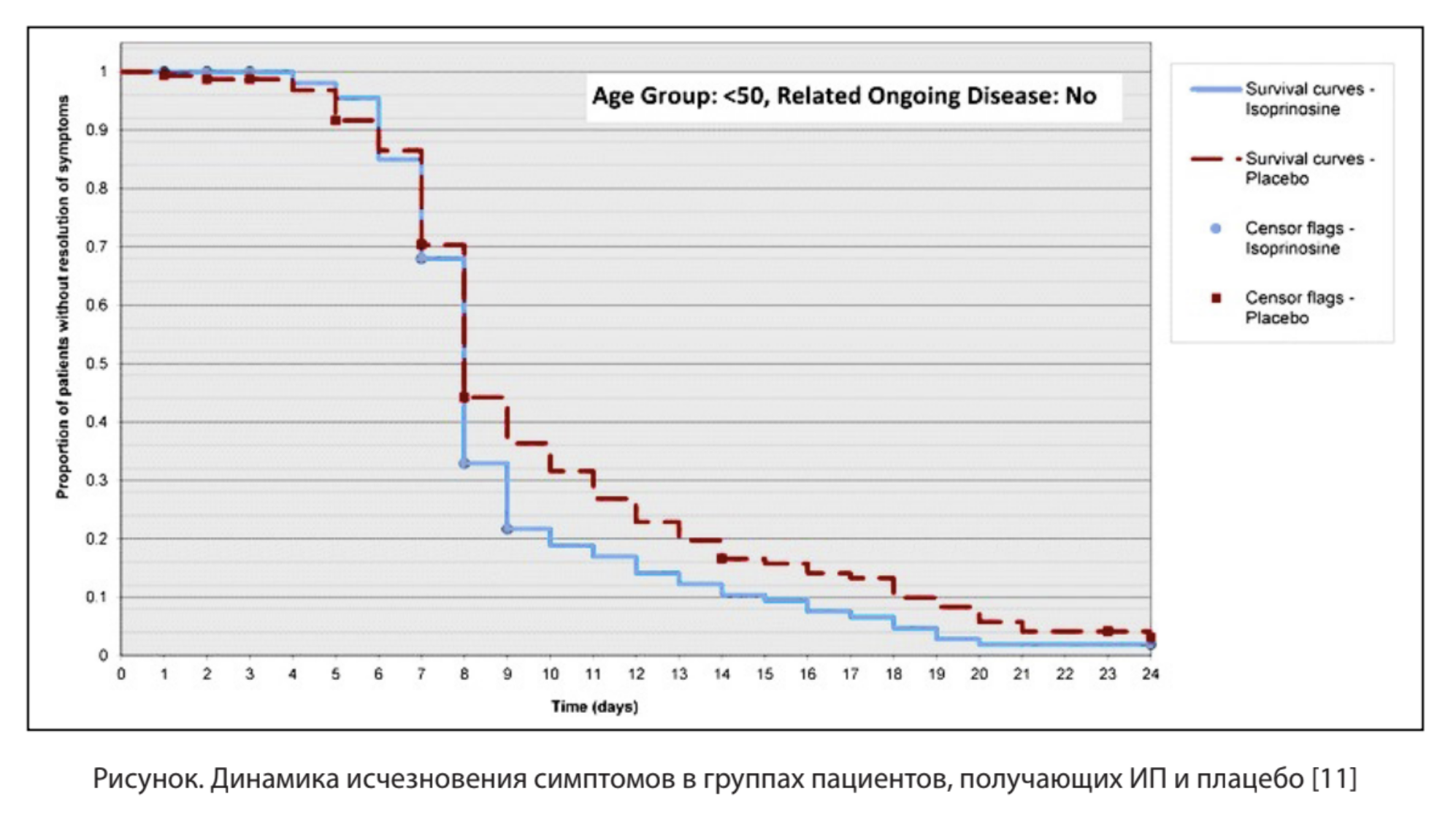
Как видно из рисунка, среди сравниваемых групп наблюдаемых пациентов моложе 50 лет без сопутствующих заболеваний имелись статистически значимые различия (р = 0,050), показавшие более быстрое улучшение состояния у пациентов, находящихся на ИП, по сравнению с пациентами в группе плацебо (ЧСС 1,234; 95 % ДИ 0,969, 1,571).
Результаты подтвердили безопасность и эффективность ИП у пациентов с гриппоподобными инфекциями без ожирения в возрасте до 50 лет с клинически диагностированными гриппоподобными заболеваниями по сравнению с плацебо.
В другом исследовании проведена оценка влияния in vitro ИП на репликацию вирусов парагриппа (HPIV-2, HPIV-4), энтеровируса A (CA16, EV71) и аденовируса C (HAdV-2, HAdV-5).
Цитотоксический эффект ИП оценивали с использованием клеточной линии A549, подвергнутой воздействию различных концентраций ИП (ИП 50–800 мкг/мл) в течение 48 ч. Противовирусный эффект оценивали по снижению титра вируса. Цитопатический эффект вируса оценивали через 48 ч после заражения клеточных культур А549 вирусами с помощью световой инвертированной микроскопии.
Жизнеспособность клеток в присутствии тестируемых соединений составляла в среднем
98,36 %. Результаты показали, что более высокие концентрации ИП ингибировали размножение всех вирусов. ИП незначительно снижал титр энтеровирусов и вирусов парагриппа по сравнению с контролем, в отличие от аденовирусов (HAdV-2, HAdV-5), проявивших наивысшую чувствительность к противовирусной активности ИП в дозе 400 мкг/мл и выше [12].
Эти же авторы в другом исследовании показали преимущества сочетанного воздействия ИП и IFN-α на подавление размножения аденовирусов (HAdV-2 и HAdV-5) [13].
Белорусский опыт изучения фармакологических эффектов ИП начался в 2009 году с установления антивирусной активности ИП (Гроприносин®), по отношению к «старым» (сезонным) и новым штаммам вируса гриппа А, в первую очередь к высокопандемичному реассортанту pdH1N1.
Изучено влияние ИП известного иммуномодулирующего препарата с противовирусной активностью на репродукцию вирусов гриппа в культуре клеток почки собаки породы кокер-спаниель (МDСК). В экспериментах использовали штаммы сезонных вирусов гриппа А/Минск/108/09 (Н3N2), А/Минск/124/08 (Н1N1), В/Минск/119/09 и штамм пандемического вируса гриппа А/Минск/94/09(Н1N1)р, выделенный от пациента, у которого инфицирование пандемическим вирусом гриппа подтверждено методом ПЦР в режиме реального времени. Противовирусную активность ИП оценивали по его способности предотвращать развитие вирусиндуцированного цитопатического действия
(ЦПД) в культуре клеток МDСК в диапазоне нецитотоксических концентраций препарата.
Исследования показали, что ИП обладает противовирусным действием в отношении вирусов гриппа А и В. Ингибирующее влияние препарата на репродукцию вирусов гриппа выявлено как при предварительной обработке культуры клеток ИП, так и при внесении его непосредственно после инфицирования монослоя.
Изучение противовирусной активности ИП в отношении вирусов гриппа не выявило типовой специфичности. ИП ингибировал репродукцию как вирусов гриппа А (Н1N1 и Н3N2), так и вируса гриппа В. В 2018 году в лаборатории гриппа и гриппоподобных заболеваний РНПЦ эпидемиологии и микробиологии (Республика Беларусь) проведено повторное испытание противовирусной активности препарата Гроприносин® в отношении 4 штаммов вирусов гриппа: А (Н1N1)pdm09, A (H3N2) и В эволюционных линий В/Виктория и В/Ямагата в культуре клеток. Результаты работы показали высокую противовирусную активность Гроприносина® в отношении всех исследованных вирусов гриппа. Ингибирующее влияние Гроприносина® на размножение вирусов
гриппа выявлено как при предварительной обработке культуры клеток (профилактический режим), так и при внесении лекарственного средства после
инфицирования клеток (терапевтический режим). В данном исследовании выявлен дозозависимый эффект – увеличение концентрации Гроприносина® сопровождалось потенцированием противовирусного действия независимо от типа вируса гриппа.
Как показали проведенные исследования, Гроприносин® обладает выраженным противогриппозным действием в отношении вирусов гриппа типа А и В.
Влияние ИП на хронические герпетические инфекции. Низкая эффективность лечения хронических рецидивирующих герпетических инфекций различной локализации предопределена их исходным иммунодефицитным потенциалом [15].
Задачей многоцентрового двойного слепого рандомизированного исследования с двойным манекеном стала сравнительная оценка ИП и ацикловира в лечении рецидивирующего герпеса половых органов у мужчин и женщин. Результаты наблюдения за 144 пациентами выявили суммарный балл симптомов (TSS) у пациентов, получавших
ИП и ацикловир на 3-й и 7-й день лечения. Не установлено различий в TSS между пациентами, принимающими ИП и ацикловир на 3-й и 5-й дни лечения. Краткосрочная частота клинических рецидивов полового герпеса при 3-месячном наблюдении была намного ниже в группе ИП, чем в группе ацикловира. Авторы делают вывод, что ИП так же эффективен, как ацикловир, при лечении рецидивирующего полового герпеса, поскольку зафиксировано более значительное снижение частоты рецидивов герпеса гениталий через 3 месяца [16].
Среди многочисленных клинических вариантов герпетических инфекций в последние годы широко обсуждается синдром хронической усталости (СХУ), называемый миалгическим энцефаломиелитом (MЭ). МЭ чаще ассоциируется с разными типами герпесвирусов (IV–VII), однако в целом нет достаточных доказательств, что СХУ является независимым, уникальным заболеванием [17, 18].
Безопасность и эффективность применения ИП при СХУ продемонстрирована в одном слепом плацебо-контролируемом исследовании на 16 пациентах с СХУ среднего возраста (45,6 года) [19]. Группа пациентов из 10 человек принимали ИП в течение 12 недель (3 г в день в нечетные недели и 1 г в день в четные недели), 6 пациентов получали таблетки плацебо с метилцеллюлозой. После 12 недель лечения пациенты из обеих групп принимали ИП в течение еще 16 недель. Мониторинг иммунологических и психологических тестов (опросники «Активность повседневной жизни», «Подмножество когнитивного дефицита», «Симптом» и «Показатель эффективности Карнофски») осуществлялся до и после лечения.
Из 10 пациентов, получавших ИП, 6 сообщили об улучшении своего состояния (улучшенная группа), средний процент снижения когнитивных симптомов среди которых составил 16 %. Применение ИП при СХУ приводило к усилению активности NK-клеток, а также к увеличению числа CD4+T-хелперных клеток в группе пациентов с клиническим улучшением состояния. Авторы полагают, что предварительные результаты исследований имеют перспективу, в связи с чем необходимы дальнейшие
исследования с адекватным объемом выборки и более длительным периодом наблюдения.
Влияние ИП на папилломавирусную инфекцию (ПВИ) продемонстрировано проведением рандомизированного плацебо-контролируемого исследования, в котором выявлен положительный терапевтический эффект в лечении остроконечных кондилом шейки матки [20]. В исследование были включены 38 белых европейских женщин в возрасте 20–43 лет с генитальными бородавками шейки матки, не поддающимися хотя бы одной традиционной терапии. Терапия состояла из приема ИП по 50 мг/кг в день
в течение 12 недель (группа 1) и плацебо (группа 2). Установлено, что терапевтическая разница между женщинами, получавшими активную и плацебо-терапию, была статистически значимой (chi (2) = 6,69, р < 0,01) и оставалась значимой, когда проводился
анализ намерения лечения (chi (2) = 7,69, р < 0,01). Ни у одной из женщин, получающих ИП, не отмечено рецидивов в течение 12 месяцев наблюдения. Побочные эффекты были незначительными и исчезали после завершения терапии. Авторы сделали вывод, что схема лечения ИП является эффективной, безопасной, альтернативной системной формой лечения цервикальных генитальных бородавок.
В другом аналогичном исследовании (двойное слепое плацебо-контролируемое) доказана высокая фармакологическая активность орального приема ИП при субклинической форме ПВИ с поражением вульвы [21]. Среди наблюдаемых 55 женщин
с поражением вульвы 22 принимали ИП по 1 г перорально 3 раза в день в течение 6 недель, а 24 получали плацебо. Результаты исследования показали, что у 14 (63,5 %) пациентов, получавших ИП, и у 4 (16,7 %), получавших плацебо, наблюдалось значительное морфологическое улучшение эпителия вульвы (р = 0,005) через 2 месяца после начала лечения. Кроме того, у 13 (59,1 %) и 9 (37,5 %) пациентов в соответствующих группах отмечено значительное снижение интенсивности зуда вульвы (р = 0,435). На этом основании сделано заключение, что терапия ИП должна рассматриваться как альтернативное лечение этого состояния.
Как известно, большинство инфекций, в первую очередь половых, не щадят обоих партнеров. В одном из исследований представлены результаты оценки эффективности ИП в комплексном лечении генитальных бородавок у мужчин [22]. Большинство пациентов были в возрасте 20–30 лет. Доказано, что комбинированная терапия, которая включала применение ИП, подтвердила долгосрочную эффективность. В группе пациентов, проходящих только деструктивные методы лечения, рецидив после 8 месяцев наблюдения диагностирован у 32 %, а у пациентов группы комбинированной терапии
(деструкция + ИП) – у 7 %. Фармакологическое действие ИП (иммуностимулирующее, противовирусное) и его сочетание с деструктивной терапией показали преимущества в комплексной терапии генитальных бородавок и профилактике рецидива
заболевания.
Влияние ИП на подострый склерозирующий панэнцефалит (ПСПЭ, SSPE). Одной из острых социальных и медицинских проблем является ПСПЭ, этиология которого до сих пор не установлена окончательно, несмотря на преобладающее мнение о роли инфицирования вирусом кори. Считают, что ПСПЭ развивается в 6,5–11 случаях на 100 000 случаев заболевания корью, преимущественно у детей, которые заразились в возрасте младше 5 лет [23].
Более 30 лет назад высказано предположение о благоприятном терапевтическом воздействии ИП на пациентов с ПСПЭ [24]. Основанием для такого заключения стал ряд работ, в которых выявлен положительный клинический эффект ИП при данной патологии. В США и Канаде ИП назначался 98 пациентам с ПСПЭ в течение различных периодов времени до 9,5 лет. Результаты выживания этих пациентов сравнивались с помощью анализа жизненного цикла с выживанием в трех контрольных группах пациентов с ПСПЭ, наблюдаемых в Израиле, Ливане или США в то же время, но не получавших ИП. Установлено, что у пациентов, получавших ИП, вероятность выживания через 2, 4, 6 и 8 лет от начала развития ПСПЭ составила 78, 69, 65 и 61 % по сравнению с 38, 20, 14 и 8 % в контрольной группе, что стало достоверно значимым отличием (р < 0,01 для всех сравнений), а риск смерти в группе лечения ИП составил 43 % от риска в контрольной группе. Было сделано важное заключение о возможности продления жизни пациентам с ПСПЭ [25].
Влияние ИП на возбудители вирусных гепатитов. В более ранних работах, посвященных
антивирусному влиянию ИП на штамм вируса гепатита А (ВГА), показано, что ИП оказывал сильное цитопатическое воздействие на клеточную линию Frp/3 через 7–9 дней после заражения ВГА. Обработка Frp/3 в диапазоне доз 125–1200 мкг/мл не имела токсического эффекта и показала дозозависимое ингибирование цикла репликации ВГА. При дозе ИП 500 мкг/мл цитопатический эффект полностью исчезал, а продукция антигена ВГА снижалась на 50 %, что подтверждено методами непрямой иммунофлюоресценции и иммуноферментным анализом (ELISA). Репликация ВГА полностью прекращалась при самой высокой использованной дозе (1000 мкг/мл) [26].
Мониторинг изменения иммунологических показателей проведен при хроническом гепатите В (ХГВ). Лечение ИП ХГВ в течение 2 месяцев сопровождалось улучшением количественных и функциональных характеристик популяции Т-клеток у пациентов с исходными нарушениями клеточного ответа. Пролонгирование иммунологических сдвигов после отмены ИП продолжалось в течение 4–5 месяцев. В случае повторного изменения нарушенных показателей повторное назначение ИП в течение одного месяца нормализовало рецидивирующие нарушения контролируемых иммунологических показателей. Стимуляция и обновление истощенных Т-клеток сопровождалось сероконверсией HDeAg/анти-HBe [27, 28].
Влияние ИП при других инфекциях и заболеваниях. Выводы из рандомизированного двойного слепого исследования с участием 22 детей в возрасте 2,7–16,8 года с диагностированной ранней инфекцией Денге позволили заключить, что ИП может быть применен в комплексной терапии лихорадки Денге [29].
Исследования in vivo, которые можно отнести к редким, проведены по оценке влияния ИП на метацестоды Echinococcus multilocularis и E. granulosus [30]. Краткосрочное и долгосрочное (от 0,5 до 4 г/кг) воздействие различными дозами ИП протестировано
на экспериментальных животных (мышах). Полученные результаты показали значительное ультраструктурное изменение метацестод E. multilocularis после кратковременного введения самой высокой дозы, а изменения тканей не было. У кист E. granulosus ультраструктурное повреждение возрастало с увеличением дозы. Таким образом, отмечено дозозависимое ультраструктурное повреждение с метаболическими
нарушениями.
Обоснованием применения ИП при туберкулезе представлено в работе, авторы которой, основываясь на иммунопатогенезе болезни, выдвинули гипотезу, что иммуностимулирующие свойства ИП могут быть использованы в качестве дополнительной терапии для лечения туберкулеза. Такой вывод основывается
на наличии у ИП способности усиливать иммунный ответ организма-хозяина за счет индукции провоспалительных цитокинов и быстрой пролиферации Т-клеточных подгрупп. Кроме того, цитокины, индуцируемые ИП, также играют решающую роль в обеспечении иммунной резистентности против Mycobacterium tuberculosis [31].
В последние годы рядом экспериментальных исследований по проблеме рака уточнены данные о механизмах действия ИП. В одной из работ проведены три анализа цитотоксичности in vitro на фибробластах мышиных эмбрионов и раковых клетках печени и определена их способность обнаруживать ранние цитотоксические эффекты для ИП. На основании оценки конечных точек цитотоксичности, изученных в клетках клона A31 BALB/3T3, сделан вывод, что клеточная мембрана может быть первой частью
клетки, на которую воздействует ИП. Распад лизосом и митохондрий следует за повреждением митохондрий. В клетках HepG2 клеточная мембрана также может быть первой частью клетки, на которую воздействует ИП. Эти результаты, безусловно, обнадеживают и нуждаются в подтверждении подобными исследованиями [32].
Клинические эффекты ИП оценивались при аутоиммунной патологии, к которой относят аллопецию [33]. 9 пациентов с тотальной алопецией и диагностированными ассоциированными дефектами функции Т-лимфоцитов прошли терапию ИП. У всех
9 произошло улучшение функции Т-клеток, а у 7 наблюдался клинически значимый рост волос. Иммунологический ответ на ИП был дозозависимым у 5 пациентов. Эти результаты подтверждают гипотезу авторов о том, что нарушения иммунологических механизмов
могут играть патогенетическую роль в тотальной алопеции у некоторых пациентов [33].
В другом исследовании среди 20 пациентов с разными типами аллопеции, обследованными иммунологически, 14 получили лечение ИП. Терапия ИП сопровождалась клиническим ответом в виде усиления роста волос у 9 из 14 пациентов. Установлено, что у 7 из 9 респондентов выявлены в крови аутоантитела до лечения, которые в процессе терапии ИП исчезли или уменьшились в титре. После терапии в обеих группах отмечалось увеличение в крови Т-розеток. Эти результаты позволили авторам предположить, что алопеция является гетерогенным заболеванием, в патогенезе которого аутоантитела имеют существенное значение [34].
Таким образом, применение ИП в экспериментальной и клинической практике в течение 50 лет доказало наличие его значимых преимуществ. Среди фармакологических эффектов, доказанных в клинических условиях при различных инфекционных и неинфекционных болезнях, доминирует иммуномодулирующий эффект ИП. Вторым механизмом, задействованным при ряде заболеваний вирусной этиологии, является прямой антивирусный эффект ИП, воздействующий непосредственно на репликативный процесс вирусной инфекции и опосредовано – через иммуностимуляцию медиаторов иммунных реакций.
